|
1.
Wren Library del Trinity College di
Cambridge: copia contenente le correzioni autografate di Newton per
la II edizione del 1713 |
|
2.
Whipple Museum of the
History of Science di Cambridge: copiaappartenuta a Robert Hooke |
|
3.
Fisher Library dell’Università di Sidney:
copia annotata da un matematico di incerta identità |
|
4.
Pepys Library in Magdalene College,
Cambridge: copia di Samuel Pepys della III edizione |
|
5.
Martin Bodmer Library: copia annotata da
Leibniz |
In Italia sono state finora censite 8 copie, tra cui
quelle della Biblioteca Nazionale di Firenze, della Nazionale di Napoli,
della Estense di Modena e dell’Alessandrina di Roma
 |
Dialogo sopra i due massimi sistemi del mondo
Galileo Galilei, 1632.
|
Il Dialogo si svolge
lungo l'arco di quattro giornate:
-Giornata prima: confronto iniziale tra sistema
copernicano (eliocentrico) e aristotelico-tolemaico (geocentrico).
- Giornata seconda: il moto di rotazione giornaliera
della Terra con particolare interessa alla (non) percezione dell’uomo di
tale fenomeno, paragonato all’analoga situazione all’interno di una barca in
movimento
- Giornata terza: discussione sulle alte e basse
maree, evidenza fisica del sistema copernicano in generale e del moto
terrestre in particolare.
- Giornata quarta: è dedicata interamente
all'argomento del flusso e reflusso del mare, considerato erroneamente da
Galilei come vero e proprio elemento probatorio dell'ipotesi copernicana.
« Io qui direi quello che intesi da persona
ecclesiastica costituito in eminentissimo grado cioè l'intenzione dello
Spirito Santo essere di insegnarci come si vadia al cielo, e non come vadia
il Cielo. »
Con Galilei arriva a
conclusione quel tema che aveva attraversato tutta la filosofia medioevale,l'intellectusfidei:
il rapporto tra ragione e fede. Tra la natura e la Scrittura, sostiene
Galilei, non ci può essere contraddizione poiché derivano ambedue da Dio,
somma verità; ma quando questo contrasto sembra esserci, si deve mettere in
dubbio la Scrittura perché la natura segue le sue leggi e non si preoccupa
di farsi capire da tutti: al contrario, la Scrittura si esprime in modo da
farsi intendere anche dagli uomini più semplici. La Scrittura rimane
comunque indiscutibile quando tratta di fede ma è essa che va interpretata
alla luce delle verità scientifiche e non viceversa; non si può cambiare la
natura perché è in contrasto con la Scrittura: è questa che si deve adattare
alle limitate capacità della comprensione umana.
L’opera è una pietra miliare per la nascita
della chimica come scienza, sottolineando e utilizzando la verifica
sperimentale in accordo con il metodo scientifico di Galilei, le
teorie vanno confermate, non è sufficiente per interpretare correttamente le
cause dei fenomeni l’osservazione e la logica come sostenevano gli
aristotelici o le idee esoteriche degli alchimisti ribadì l’importanza di
distinguere ciò che si sa essere vero da ciò che si suppone lo sia.
Boyle indica i requisiti di una buona ipotesi:
‘che sia
intelligibile’
‘che non contenga
niente di impossibile o assurdo’
‘che sia coerente
con se stessa’
‘che sia adatta e
sufficiente a spiegare i fenomeni, in particolar modo i principali’
‘che non contraddica
nessun altro fenomeno naturale noto
‘.
I personaggi del Chimico Scettico sono oltre al
narratore “io”, quattro personaggi: Temistio (sostenitore di Aristotele),
Filipono (seguace di Paracelso, medico e chimico svizzero del XVI secolo,
fautore della “teoria dei 3 elementi primi”, secondo la quale le qualità di
un corpo erano spiegate con la composizione degli elementi primi: sale,
mercurio e zolfo), Carneade (lo stesso Boyle) ed Eleuterio, un libero
pensatore.
Boyle , nella prima parte dell’opera , confuta le
teorie aristotelica e alchemica di Paracelso che la materia sia formata solo
dagli quattro elementi aristotelici o dai principi di Paracelso, ma che era
necessario indagare sperimentalmente nella ricerca di nuovi elementi
per spiegare la natura dei fenomeni, inoltre rifiutò che il metodo di
analisi tradizionalmente utilizzato per l’analisi e decomposizione delle
sostanze in elementi non era corretto, dimostrò infatti per via sperimentale
che il fuoco in molti casi ricombina gli ingredienti dei corpi invece di
separarli. Poi Boyle propone una teoria corpuscolare :la materia viene
‘divisa in parti per effetto del moto; queste parti sono necessariamente
dotate di dimensione, forma e movimento o quiete’;
A chi aveva convinzioni profondamente
radicate, Boyle ribadì l’importanza di distinguere ciò che si sa essere vero
da ciò che si suppone lo sia
 |
Traité Élémentaire de Chimie
Il trattato elementare di chimica venne pubblicato in
Francia nel 1789, consistente in 2 volumi
e successivamente tradotto in Italia nel 1791 in 4 tomi. Il testo può essere considerato come il primo libro moderno di chimica ed è per questa opera che si attribuisce la paternità della chimica moderna a Lavoisier.
|
Il Traité Élémentaire de Chimie (Trattato di chimica elementare),è considerato il primo moderno libro di chimica con una visione unificata delle nuove teorie.
-legge della conservazione della massa
Si parte con una chiara formulazione della , una controtendenza
rispetto alle idee in vigore all’epoca. «Rien ne se perd, rien ne se
crée» ("Nulla si perde, nulla si crea").
-
- negazione del flogisto viene confutata la teoria del flogisto, teoria elaborata nel XVII secolo con l’intento di spiegare i processi di ossidazione e combustione, in cui veniva appunto prodotta questa sostanza denominata ‘flogisto’ (dal greco, fiamma), misterioso principio d’infiammabilità:
metallo → calce + flogisto
Tale teoria fu confutata da Lavoisier con esperimenti quantitativi e sostituì quella che era definita aria deflogisticata, con oxygine, nuovo elemento contenuto nella sua lista
- una
teoria della formazione dei composti chimici a partire dagli
elementi. In aggiunta stilò una lista di elementi
ossigeno, azoto, idrogeno, fosforo, mercurio, zinco, e zolfo.
« Alla folla è bastato un solo istante per
tagliare la sua testa; ma alla Francia potrebbe non bastare un secolo per
produrne una simile. »
J..L. Lagrange
sull’esecuzione di Lavoisier

|
definizione di elemento di Lavoiser
« Se noi attribuiamo al nome di
elementi o di principi
dei corpi l'idea dell'ultimo termine al quale
giunge l'analisi, tutte le sostanze che non abbiamo potuto decomporre con alcun
mezzo sono per noi elementi; non che noi possiamo essere sicuri che questi corpi
semplici non siano essi stessi composti di due o anche di più gran numero di
principi, ma poiché questi principi non si separano mai o, piuttosto, poiché noi
non abbiamo alcun mezzo per separarli, essi agiscono nei nostri confronti come
dei corpi semplici, e noi non dobbiamo supporli composti fino al momento in cui
l'esperienza e l'osservazione non ce ne abbiano fornito la
|
|
|
1 Leggi di Newton;
2 Studio dei volumi
dei gas e calcolo dei pesi relativi;
3 Legge delle proporzioni nelle
combinazioni chimiche*;
4 Legge di Dalton sulle pressioni parziali**;
La teoria
prevede 5 punti fondamentali:
●
Tutta la materia è fatta da particelle
microscopiche indistruttibili e indivisibili chiamate atomi.
●
Tutti gli atomi di
uno stesso elemento sono identici e hanno uguale massa.
●
Gli atomi di un
elemento non possono essere convertiti in atomi di altri
elementi.
●
Gli atomi di un
elemento si combinano, per formare un composto, solamente
con numeri interi di atomi di altri elementi.
●
Gli atomi non possono
essere né creati né distrutti, ma si trasferiscono interi da
un composto ad un altro.
La teoria si trova in accordo con
la legge di conservazione della massa (formulata da Lavoisier alcuni anni prima)
la legge delle proporzioni di definite di Proust.
Legge di
Dalton delle proporzioni multiple: se due
elementi si combinano tra loro, formando composti diversi,
le quantità di uno di essi che si combinano con una quantità
fissa dell'altro stanno fra loro in rapporti razionali,
espressi da numeri interi e piccoli.”
legge delle pressioni
parziali di Dalton: quando due o
più gas, che non reagiscono fra loro, sono contenuti in un
recipiente, la pressione totale del loro miscuglio è uguale
alla somma delle pressioni che ogni gas eserciterebbe se
occupasse da solo tutto il recipiente.”
Dalton , forse, sviluppò la sua teoria atomica dall’osservazione sperimentale di quelli che lui chiamava “fluidi elastici”, oggi conosciuti come vapori, che egli considerava costituiti da particelle, si doveva spiegare perchè un fluido si dilata ( forze repulsive) e la mescolanza di fluidi diversi ( nessuna interazione)

gli atomi degli
elementi sono rappresentati da cerchi e differenziati con
semplici elementi geometrici punto, segmenti…, i
composti dai segni degli elementi legati

Dalton pubblicò
una serie di articoli
dal titolo "Saggi sperimentali sulla
costituzione di gas misti; sulla pressione
del vapore e di altri vapori a diverse
temperature, sia nel vuoto che nell'aria;
per evaporazione; e sulla dilatazione
termica dei gas ". Nei suoi articoli
descrive gli esperimenti condotti per
scoprire con certezza la pressione del
vapore in vari punti tra 0 e 100 gradi
Celsius. Dalton fece osservazioni delle
pressioni di vapore di sei diversi liquidi e
concluse che la variazione della pressione
di vapore per tutti i liquidi è equivalente,
per la stessa variazione di temperatura,
calcolata dal vapore di una data pressione.
Queste scoperte furono l'inizio essenziale
della sua teoria atomica.
|
|
“La Chimica è
la scienza che fa conoscere la composizione dei corpi, e la
maniera con cui si comportano gli uni riguardo gli altri.
Non è molto che essa prese un posto tra le Scienze, e in
gran parte essa è debitrice della sua origine ai tentativi
per far dell’oro. Il suo nome è di origine araba. A un tempo
esso portava il nome di Alchimia; ma non adoprasi più qdi
questa parola presentemente che per esprimere l’arte di far
dell’oro. Al è l’articolo degli arabi, in guisa che alchimia
significa semplicemente la chimica. Varie scienze, arti e
mestieri sono basati quasi unicamente sulla chimica, che,
tra tutte le scienze, è quella di cui si fa un maggior
numero di applicazioni ai bisogni della vita.”
Con questa
definizione di Chimica esordisce nel suo trattato,
ponendola come prerogativa per le sue definizioni e sviluppi
successivi.
A Berzelius va
il merito di aver scoperto alcuni elementi della Tavola
Periodica, quali Cerio, Silicio, Selenio e Torio,
dell’introduzione del concetto di chimica organica (sebbene
egli credesse nella teoria della “Vis Vitalis”, una forza
misteriosa prerogativa degli organismi viventi ) e di aver
dato origine alla simbologia degli elementi così come la
conosciamo, introducendo una sigla per ogni atomo ed un
apice per indicare il numero di atomi nel composto.
Nella
prefazione del Trattato di chimica viene fatto notare come
sia necessario far nascere negli studenti la curiosità senza
però soddisfarla immediatamente, in maniera tale da
alleggerire lo studio ed incuriosire sempre più. Inoltre
viene fatto notare come lo studio della chimica sia ormai
imprescindibile da quello della fisica, infatti, nonostante
vi sia una breve introduzione ai fenomeni fisici, viene
presupposto che gli studenti abbiano già delle nozioni di
fisica. Infine Berzelius suppone che che la “filosofia
corpuscolare” e le “interazioni elettriche” confluiranno in
un’unica teoria in futuro.
Nei primi due
tomi del testo, viene presentata in maniera dettagliata la
chimica inorganica conosciuta all’epoca, con un’introduzione
nella prima parte del tomo 1 riguardante la nomenclatura,
che è difatti la nomenclatura tradizionale tutt’oggi
utilizzata e che viene posta prima di qualsiasi altro
concetto chimico, e le “sostanze semplici imponderabili”
quali luce, calorico, elettricità etc.
La discussione
procede con un’analisi dettagliata dei metalloidi (12), dei
metalli “elettropositivi” (31) e elettronegativi” (9).
Nonostante non ci sia una definizione precisa di acido
all’interno del testo, Berzelius li suddivide in
ossoacidi e idracidi, quest’ultimi a radicale semplice (i
classici acidi alogenidrici) o a radicale composto (gli
attuali acidi carbossilici). Un particolare notato è che
questi acidi sono meno forti dei loro corrispettivi
minerali, nonostante “colorino la cartina al tornasole”.
Con il terzo
tomo Berzelius introduce il concetto fondamentale di Chimica
Organica come chimica degli esseri viventi. Tuttavia secondo
il chimico svedese “Nella natura organica gli elementi
sembrano obbedire a leggi affatto diverse che nella natura
inorganica; i prodotti risultanti dall’azione
reciproca di
questi elementi differiscono quindi da quelli che ci offre
la natura inorganica. Scuoprendo la causa di questa
differenza ,si avrebbe la chiave della teoria della chimica
organica. Ma questa teoria ci è talmente nascosta che
non abbiamo speranza alcuna di svelarla in niuna guisa,
almeno finora.”. Inoltre, gli esseri viventi vengono
definiti dei laboratori chimici i cui prodotti sono quella
che noi definiamo vita. Un corpo organico è caratterizzato
da “un principio ostensibile, seguito dal suo sviluppo,
dalla sua decadenza e dalla sua distruzione; mentre il corpo
inorganico esisteva prima di noi, e continua ad esistere,
per modo che, non soggiacendo a decomposizione chimica,
sussisterà sempre.”
Il tomo
procede con l’introduzione alla chimica vegetale (dominata
da carbonio, idrogeno e ossigeno), sia nella prima che nella
seconda parte, per poi passare all’introduzione della
chimica animale (dominata da carbonio, ossigeno, idrogeno e
azoto, con una presenza minoritaria di altri elementi), i
principali apparati del corpo umano ed alcuni animali,
mentre nella seconda parte è presente un glossario dei
termini utilizzati e delle principali apparecchiature e/o
tecniche di laboratorio, con tanto di schemi finali.

|
Articolo di
in Annals of
Philosophy, or Magazine of Chemistry, Mineralogy, Mechanics, Natural
History, Agriculture and the Arts 2 (II), pp. 276-284 and 357-368,
1813
...simboli chimici dovrebbero
essere lettere, per la maggior facilità di scrittura e non deturpano
un libro stampato. Anche se questa ultima circostanza potrebbe non
essere di una certa importanza, che dovrebbe essere evitato ogni
volta che si può fare. Prenderò dunque, per il simbolo di chimico,
il lettera iniziale del nome latino di ogni sostanza elementare:
ma come molti hanno la stessa lettera iniziale, devo a distinguerli
nel modo seguente: - 1. Nella classe che io chiamo metalloidi,
io devo impiegare la lettera iniziale solo, anche quando questa
lettera è comune il metalloide e del metallo. 2. nella classe dei
metalli, io devo distinguere quelli che hanno le stesse iniziali con
un altro metallo, o un metalloide, scrivendo le prime due lettere
della parola. 3. se le prime due lettere essere comune ai due
metalli, in tal caso, aggiungerò alla lettera iniziale la prima
consonante che hanno non in comune: ad esempio, S = zolfo, Si =
silicio, St = stibium (antimonio)[2],
Sn = stannum (tin), C = carbonicum, Co = c obaltum (cobalto), Cu =
cuprum (rame), O = ossigeno, Os = osmio & c
.
|
 |
Elementi di filosofia chimica di Humphry Davy,1814
|
||
|
Chimico inglese a cavallo tra il XVIII e il XIX secolo, è considerato uno dei padri fondatori dell’elettrochimica; membro e successivamente presidente della Royal Society, anche Professore presso la Royal Institution della Gran Bretagna ll
trattato, diviso in 2 Volumi (ognuno
suddiviso in 3 e 4 Divisioni rispettivamente), è
ricordato come fondamentale nella storia della
chimica poiché vengono in esso sviluppati
metodi elettrochimici(elettricità e pile
come quella di Volta), atte a separare sali in
soluzioni (moderna elettrolisi, studiando anche
le Energie coinvolte in tale separazione) e Sali
fusi con formazione di metalli (Na e K, scoperti
proprio grazie ai suoi metodi di separazione,
nel 1807; Ca, Sr, Ba, Mg, B nel 1808).
|
|||
|
Chimico inglese a
cavallo tra il XVIII e il XIX secolo, è
considerato uno dei padri fondatori
dell’elettrochimica; membro e successivamente
presidente della Royal Society, anche Professore
presso la Royal Institution della Gran Bretagna Il trattato, diviso in 2
Volumi (ognuno suddiviso in 3 e 4 Divisioni
rispettivamente), è ricordato come fondamentale
nella storia della chimica poiché vengono in
esso sviluppati metodi elettrochimici(elettricità
e pile come quella di Volta), atte a separare
sali in soluzioni (moderna elettrolisi,
studiando anche le Energie coinvolte in tale
separazione) e Sali fusi con formazione di
metalli (Na e K, scoperti proprio grazie ai suoi
metodi di separazione, nel 1807; Ca, Sr, Ba, Mg,
B nel 1808). Prefazione. Speculazione filosofica
Il primo volume del trattato ha un’ ampia
prefazione, Davy riporta il lungo cammino
della scienza chimica dalle speculazioni
filosofiche antiche alle teorie moderne . I
cambiamenti dei corpi hanno
una spiegazione mitologica e speculativa per i
sacerdoti egiziani, la fertilità delle zone
alluvionate dal Nilo faceva concepire l’acqua
origine delle varie forme della materia.
Questo dogma caratterizza la prima scuola
dei Greci. Per Talete di Mileto l’acqua è
l’origine di tutte cose.“ La filosofia greca ,
pur essendo speculativa, ha il grande merito di
sostituire alla conoscenza del mito, la ricerca
delle cause . Alchimia Il
giudizio sugli alchimisti è pacato, negativo sul
linguaggio ermetico e sui principi, viene
riconosciuto il merito di aver
sviluppato metodi pratici
utili ai chimici , cita Bacone, assertore
dell’esperienza*, che paragona gli alchimisti a
quei lavoratori che convinti di un tesoro celato
sotto terra, rivolgono e
dividono il suolo rendendolo fertile. [ bacone*] La
nomenclatura chimica
proposta dai chimici francesi è accolta dai
chimici inglesi , con alcune eccezioni per i
nomi di composti che implicano errori nella
composizione Per la nomenclatura
degli ossidi viene accettata la
proposta di Thomson , che fa
precedere Il nome di ossido da prefissi
trattid ai nomi dei numeri in greco
: deutossido, triossido,
tetrossido quando i
corpi contengono 2, 3, 4
proporzioni di ossigeno Introduzione Oggetto della filosofia
chimica è la ricerca dei vari fenomeni naturali
quando una materia si trasforma in un'altra e la
scoperta delle leggi
che li governano Principi di ricerca
Basi della scienza
sono l'osservazione , l’esperienza e
l’analogia.. L’osservazione guidata
dall’analogia conduce all ’esperienza. “Questi principi di ricerca
sono stati adottati di recente e hanno dato
grandi risultati ala filosofia chimica: le più
belle scoperte e i regolamenti teoretici più
felici.” Nota i termini utilizzati sono
quelli dell’autore , con lo sviluppo della
scienza chimica sono stati modificati ad esempio
corpi (composti) contengono 2 3 4
proporzioni (numero di atomi nella molecola
di ossigeno. Considerazioni sui
progressi della scienza, I processi chimici
conosciuti dalle civiltà antiche-:la
metallurgia, la tintura , la lavorazione del
vetro ,della porcellana, arti che erano
indipendenti l’una dall’altra senza cognizioni
generali, hanno principi e leggi in comune. Il 1° volume,
“Sopra le leggi dei cangiamenti chimici, sopra i
corpi decomposti e sopra le loro primarie
combinazioni”, diviso in 3 Divisioni:
1.
Sulle forze e
proprietà della materia e sopra le leggi
generali de’ cambiamenti chimici:
Costituzione della materia; Forze di
gravitazione, coesione e calore (repulsione
calorifica); Leggi chimiche di attrazione,
combinazione e decomposizione; Leggi
elettriche di attrazione e repulsione
2.
Della materia
raggiante o eterea: Effetti
nella produzione di fenomeni della vista, della
produzione del calore e dei cambiamenti chimici
3.
Delle sostanze
indecomposte empiree (brucianti) o che
mantengono la combustione, e delle loro mutue
combinazioni Nella prefazione
l’autore riporta una breve storia della chimica, Oltre a Proprietà e
forze della materia, a leggi chimiche ed
elettriche, si trovano in tale volume anche
definizioni che saranno la base per gli
sviluppi successivi, come quella della
Temperatura: “facoltà che possiedono i corpi di
comunicare/ricevere calore, ovvero Forza di
repulsione; quantitativamente alta o bassa in
base alla contrazione o alla dilatazione delle
sue parti. Misurabile con il termometro.” E’ inoltre definito di
particolare importanza il ruolo dell’acqua: “in
molte soluzioni, riguardo all’insieme degli
elementi impegnati in una combinazione di
chimica, la loro separazione non dipende solo
dall’attrazione delle loro parti, ma anche come
l’acqua vi agisce.” Come già accennato, è
anche sottolineato lo sviluppo della Chimica e
delle condizioni a cui possa essere studiata in
maniera ottimale: “è necessario avere idee
riguardo alle Forze costantemente in azione,
come l’affinità (senza, la chimica sarebbe senza
guida, senza combinazioni certe, precludendo la
possibilità di condurre analisi).
Fortunatamente, i cangiamenti del ciclo degli
avvenimenti terrestri (data la disposizione dei
cieli e dei movimenti dei pianeti) porta il
carattere dell’uniformità e della semplicità,
pertanto sono applicabili metodi per calcolarli
e misurarli, con loro conseguente ordine e
scoperta delle Leggi che li regolano”. Vengono, alla fine del
primo volume, date le prime definizioni di
elettricità, conduttori, elettrizzazione e
strumenti (pila di Manchester) Il 2° volume è
concentrato sulle materie trattate, com’è
possibile notare dalle 4 Divisioni che lo
caratterizzano:
1.
Delle sostanze
combustibili indecomposte (modificabili non
metalliche) e le loro combinazione coll’ossigeno
e clorino, o tra di loro
2.
Dei Metalli,
combinazione reciproche e binarie con altri
corpi indecomposti: Sodio,
Potassio
3.
Di alcune sostanze di
cui non si conosce ancora con certezza la natura
4.
Su Analogie tra
sostanze indecomposte; idee teoretiche sulla
loro natura; mezzi per disunirle e relazioni tra
i loro composti Ciò che si nota in tale
testo è il modo in cui Davy vede la natura e il
suo aspetto fenomenologico: se si era abituati
(e spesso lo si è tutt’oggi) a partire dalla
base, dal piccolo, fino ad arrivare al
complesso, qui si può vedere come sia possibile
ed intrigante agire a ritroso (partendo dai Sali
minerali) Altra osservazione
interessante da poter notare è che, come in
tutti i testi di allora, manca il linguaggio
chimico: è possibile notare infatti la completa
assenza di formule e schemi, salvo alcuni
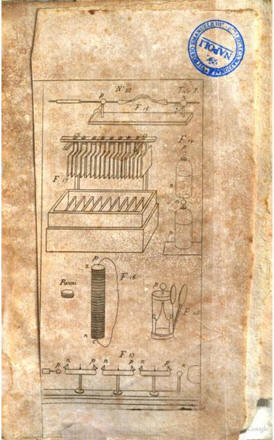
modelli di pile all’epilogo del volume e tavole
di riepilogo dei conduttori (simile alle moderne
tavole di Potenziali elettrochimici)
|
|||